En este estudio pionero, se trata a pacientes con cáncer de pulmón con una vacuna autóloga de DC impulsada por un péptido neoantígeno personalizado, lo que representa un avance prometedor en el campo del tratamiento del cáncer de pulmón. El enfoque dirigido a los neoantígenos ha demostrado un gran potencial para activar la respuesta inmunitaria del organismo contra las células cancerosas. La naturaleza personalizada de la vacuna permite planes de tratamiento a medida que tienen en cuenta las características individuales de cada paciente, lo que en última instancia conduce a mejores resultados y calidad de vida.
Pacientes con cáncer de pulmón confirmado histológica o citológicamente, incluidos carcinoma de células escamosas, adenocarcinoma, tumor neuroendocrino y CPCP, con edades comprendidas entre 18 y 75 años y con al menos una enfermedad medible según el RECIST. El paciente debe haber sido sometido a terapias estándar y tener enfermedades progresivas. La esperanza de vida debe ser de al menos 3 meses. Estado funcional 0 ó 1 del Eastern Cooperative Oncology Group (ECOG), así como funciones ósea, renal y hepática adecuadas.
Preparación de ADN y ARN
Los tejidos tumorales se obtuvieron mediante biopsia por fibrobroncoscopia, resección de ganglio linfático metastásico supraclavicular, aspiración con aguja fina de lesión lumbar metastásica y aspiración con aguja fina de lesiones tumorales pulmonares y se almacenaron con 1 ml de ARN posterior (Thermo Fisher, #AM7020). Se extrajo sangre y se mezcló con un anticoagulante a base de EDTA. El ADN y el ARN se extrajeron del mismo tejido tumoral con el All Prep DNA/RNA Mini Kit, y el ADN de sangre periférica anticoagulada con EDTA se extrajo con el QIAamp DNA Blood Mini Kit. La calidad del ADN/ARN se evaluó con el bioanalizador 2100. Se prepararon muestras trío (dos muestras de ADN del tumor y de la sangre, y una muestra de ARN sólo del tumor) de cada paciente para el posterior proceso de secuenciación.
Preparación de ADN y ARN
Los tejidos tumorales se obtuvieron mediante biopsia por fibrobroncoscopia, resección de ganglio linfático metastásico supraclavicular, aspiración con aguja fina de lesión lumbar metastásica y aspiración con aguja fina de lesiones tumorales pulmonares y se almacenaron con 1 ml de ARN posterior (Thermo Fisher, #AM7020). Se extrajo sangre y se mezcló con un anticoagulante a base de EDTA. El ADN y el ARN se extrajeron del mismo tejido tumoral con el All Prep DNA/RNA Mini Kit, y el ADN de sangre periférica anticoagulada con EDTA se extrajo con el QIAamp DNA Blood Mini Kit. La calidad del ADN/ARN se evaluó con el bioanalizador 2100. Se prepararon muestras trío (dos muestras de ADN del tumor y de la sangre, y una muestra de ARN sólo del tumor) de cada paciente para el posterior proceso de secuenciación.
Las PBMC se aislaron de la sangre periférica de los pacientes. Se inocularon 5-10 × 106/ml de PBMC elutriadas en matraces T175 con medio AIM-V y se incubaron durante 3 h a 37 °C y 5% de CO2. A continuación, se recogieron las células en suspensión y se congelaron en nitrógeno líquido. Las células adherentes se lavaron y se cultivaron en medio AIM-V que contenía un 1% de suero autólogo, GM-CSF humano de grado clínico (1000 UI/ml) e IL-4 de grado de investigación sin animales (500 UI/ml). Transcurridos 5 días, se añadieron los péptidos neoantígenos (50 μg/ml) a las DC inmaduras. Tras 20-24 horas de carga de péptidos, las DC se maduraron con TNF-α (10 ng/ml), IL-1β (10 ng/m), IFN-γ (1000 U/ml), prostaglandina E2 (PGE2, 250ng/ml) R848 (1μg/ml) y ácido polinosínico-policidílico (20 ng/ml; poli (I:C)) y se incubaron durante 20-24 horas.
Los pacientes fueron pretratados con ciclofosfamida a una dosis de 250 mg/m2 1 día antes de la inyección de Neo- DCVac. El Neo-DCVac preparado se vacunó por vía subcutánea en las regiones axilar e inguen bilateralmente en el día 0. Se administró GM-CSF a una dosis de 0,075 mg durante los 5 días siguientes (días 1- 5).
EA y toxicidad
Todos los acontecimientos adversos se limitaron a grado 1 o 2. Todos los pacientes experimentaron reacciones cutáneas de grado 1 en el punto de inyección. El paciente 4 desarrolló neutropenia transitoria de grado 1 tras recibir el tratamiento con Neo-DCVac, que se alivió sin ningún tratamiento. El paciente 12 desarrolló una erupción pruriginosa de grado 2 en todo el tronco y las extremidades. No se administró ningún otro tratamiento específico, y su erupción remitió tras el cese de la vacunación. Neo-DCVac no aumentó el riesgo de acontecimientos adversos inmunológicos relacionados con los ICI. Ninguna toxicidad limitó la dosis ni obligó a retrasarla o a interrumpir el tratamiento.
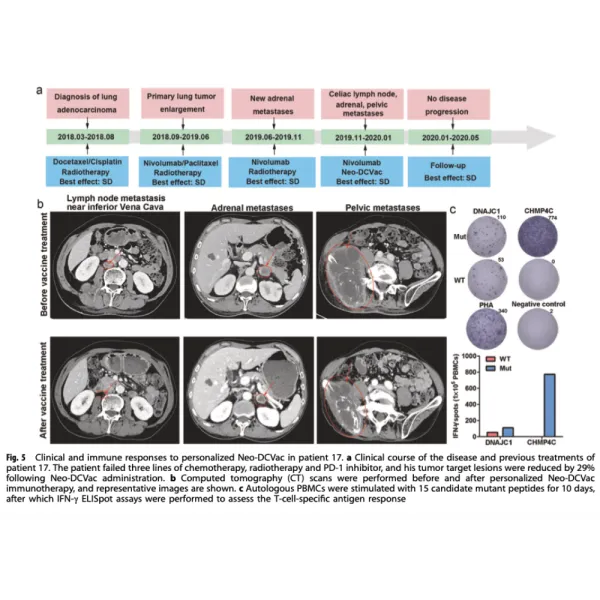
La mediana de la supervivencia libre de progresión (SLP) fue de 5,5 meses (intervalo de confianza [IC] del 95%, 1,9-9,2), y la mediana de la supervivencia global (SG) fue de 7,9 meses (IC del 95%, 5,9-10,0). Tres (25%) de 12 pacientes lograron una respuesta objetiva. Todas las respuestas fueron RP, sin que se registraran respuestas completas (RC). Seis (50%) de los 12 pacientes experimentaron una disminución del tamaño de sus lesiones diana, nueve (75%) de los 12 pacientes alcanzaron el control de la enfermedad, y se registró enfermedad progresiva (EP) en tres pacientes (25%).
Los resultados de este estudio piloto han demostrado que Neo- DCVac es factible, seguro y capaz de provocar una inmunidad específica de células T y un beneficio terapéutico. Primeros hallazgos sobre la actividad de un tratamiento con una vacuna de DC basada en neoantígenos en pacientes con CPNM avanzado. Quizá lo más importante sea que Neo-DCVac podría tener implicaciones en una amplia gama de cánceres.
Enlace de referencia del artículo: click aquí
Fecha de publicación del artículo científico 1/21/2021
REGISTERED ADDRESS:
Immunyo Ltd
Kincora Ave 35
Clontarf
Dublin 3
Ireland
International
For Germany, Austria and Switzerland