Dans cette étude révolutionnaire, des patients atteints de cancer du poumon sont traités avec un vaccin CD autologue personnalisé pulsé par des peptides néoantigènes, ce qui représente une avancée prometteuse dans le domaine du traitement du cancer du poumon. L’approche consistant à cibler les néoantigènes s’est révélée très prometteuse pour activer la réponse immunitaire de l’organisme contre les cellules cancéreuses. La nature personnalisée du vaccin permet d’élaborer des plans de traitement sur mesure qui tiennent compte des caractéristiques individuelles des patients, ce qui se traduit en fin de compte par de meilleurs résultats et une meilleure qualité de vie.
Les patients atteints d’un cancer du poumon confirmé histologiquement ou cytologiquement, y compris le carcinome épidermoïde, l’adénocarcinome, la tumeur neuroendocrine et le SCLC, âgés de 18 à 75 ans et présentant au moins une maladie mesurable selon la norme RECIST. Le patient doit avoir suivi des thérapies standard et avoir une maladie en progression. L’espérance de vie devrait être d’au moins 3 mois. Statut de performance de l’Eastern Cooperative Oncology Group (ECOG) de 0 ou 1, ainsi que des fonctions médullaires, rénales et hépatiques adéquates.
Préparation de l’ADN et de l’ARN
Les tissus tumoraux ont été obtenus par biopsie sous bronchoscopie, résection de ganglions lymphatiques métastatiques supraclaviculaires, aspiration à l’aiguille fine d’une lésion lombaire métastatique et aspiration à l’aiguille fine de lésions tumorales pulmonaires et conservés avec 1 ml d’ARN par la suite (Thermo Fisher, #AM7020). Le sang a été prélevé et mélangé à un anticoagulant à base d’EDTA. L’ADN et l’ARN ont été extraits du même tissu tumoral à l’aide du minikit All Prep DNA/RNA, et l’ADN du sang périphérique anti coagulé par EDTA a été extrait à l’aide du minikit QIAamp DNA Blood. La qualité de l’ADN/ARN a été évaluée par le Bioanalyseur 2100. Pour chaque patient, trois échantillons (deux échantillons d’ADN provenant de la tumeur et du sang, et un échantillon d’ARN provenant uniquement de la tumeur) ont été préparés pour le processus de séquençage ultérieur.
Préparation de l’ADN et de l’ARN
Les tissus tumoraux ont été obtenus par biopsie sous bronchoscopie, résection de ganglions lymphatiques métastatiques supraclaviculaires, aspiration à l’aiguille fine d’une lésion lombaire métastatique et aspiration à l’aiguille fine de lésions tumorales pulmonaires et conservés avec 1 ml d’ARN par la suite (Thermo Fisher, #AM7020). Le sang a été prélevé et mélangé à un anticoagulant à base d’EDTA. L’ADN et l’ARN ont été extraits du même tissu tumoral à l’aide du minikit All Prep DNA/RNA, et l’ADN du sang périphérique anti coagulé par EDTA a été extrait à l’aide du minikit QIAamp DNA Blood. La qualité de l’ADN/ARN a été évaluée par le Bioanalyseur 2100. Pour chaque patient, trois échantillons (deux échantillons d’ADN provenant de la tumeur et du sang, et un échantillon d’ARN provenant uniquement de la tumeur) ont été préparés pour le processus de séquençage ultérieur.
Les PBMC ont été isolés à partir du sang périphérique des patients. 5-10 × 106/ml de PBMC élutriés ont été inoculés dans des flacons T175 contenant du milieu AIM-V et incubés pendant 3 heures à 37 °C et 5 % de CO2. Les cellules en suspension ont ensuite été recueillies et congelées dans l’azote liquide. Les cellules adhérentes ont été lavées et cultivées dans un milieu AIM-V contenant 1% de sérum autologue, du GM-CSF humain de qualité clinique (1000 UI/ml) et de l’IL-4 de grade recherche exempt d’animaux (500 UI/ml). Après 5 jours, les peptides néoantigènes (50 μg/ml) ont été ajoutés aux CD immatures. Après 20-24 heures de chargement de peptides, les CD ont été maturées avec du TNF-α (10 ng/ml), de l’IL-1β (10 ng/m), de l’IFN-γ (1000 U/ml), de la prostaglandine E2 (PGE2, 250ng/ml) R848 (1μg/ml), et de l’acide polyinosinique- polycytidylique (20 ng/ml ; poly (I:C)) et ont été incubées pendant 20-24 heures.
Les patients ont été prétraités avec du cyclophosphamide à une dose de 250 mg/m2 1 jour avant l’injection de Neo- DCVac. Le Neo-DCVac préparé a été vacciné par voie sous-cutanée dans les régions axillaire et inguen de façon bilatérale au jour 0. Le GM-CSF a été administré à une dose de 0,075 mg pendant les 5 jours suivants (jours 1 à 5).
EI et toxicité
Tous les effets indésirables se sont limités à un grade 1 ou 2. Tous les patients ont présenté des réactions cutanées de grade 1 au point d’injection. Le patient 4 a développé une neutropénie transitoire de grade 1 après avoir reçu le traitement par Neo-DCVac, qui a été soulagée sans aucun traitement. Le patient 12 a développé une éruption cutanée de grade 2 avec démangeaisons sur le tronc et les extrémités. Aucun autre traitement spécifique n’a été administré et l’éruption a disparu après l’arrêt de la vaccination. Le Neo-DCVac n’a pas augmenté le risque d’effets indésirables d’origine immunitaire liés aux ICIs. Aucune toxicité n’a limité la dose ou n’a entraîné un retard de dose ou l’arrêt du traitement.
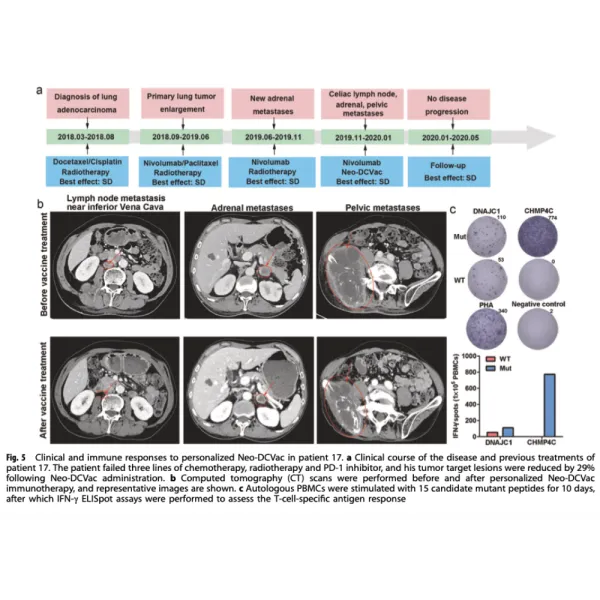
La médiane de la survie sans progression (PFS) était de 5,5 mois (intervalle de confiance à 95 % (IC, 1,9-9,2), et la médiane de la survie globale (SG) était de 7,9 mois (IC à 95 %, 5,9-10,0). Trois (25 %) des 12 patients ont obtenu une réponse objective. Toutes les réponses étaient des RP, aucune réponse complète (RC) n’ayant été enregistrée. Six (50 %) des 12 patients ont connu une diminution de la taille de leurs lésions cibles, neuf (75 %) des 12 patients ont obtenu un contrôle de la maladie et une maladie progressive a été enregistrée chez trois patients (25 %).
Les résultats de cette étude pilote ont prouvé que le Neo- DCVac est faisable, sûr et capable de susciter une immunité spécifique des cellules T et un bénéfice thérapeutique. Premiers résultats de l’activité d’un vaccin CD à base de néoantigènes chez des patients atteints d’un cancer du poumon non à petites cellules (NSCLC) à un stade avancé. Peut-être plus important encore, Neo-DCVac pourrait avoir des implications dans un large éventail de cancers.
Lien de référence de l’article : cliquez ici
Date de publication de l’article scientifique 1/21/2021
REGISTERED ADDRESS:
Immunyo Ltd
Kincora Ave 35
Clontarf
Dublin 3
Ireland
International
For Germany, Austria and Switzerland