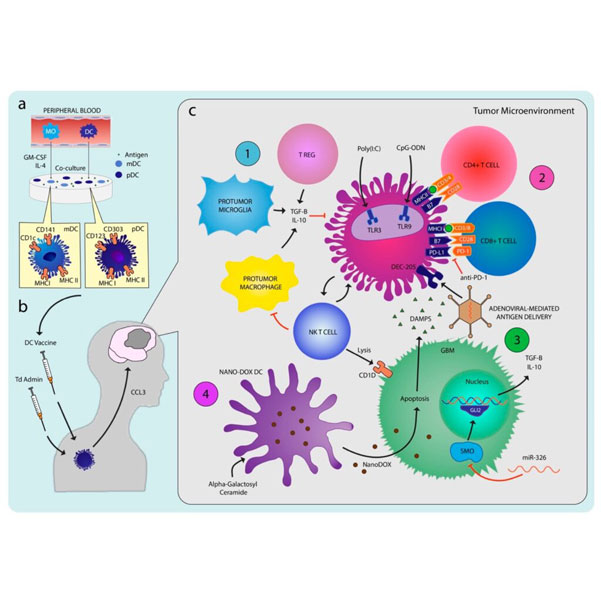
El glioblastoma (GBM) es una neoplasia maligna primaria devastadora del sistema nervioso central en adultos, con opciones de tratamiento limitadas y una tasa media de supervivencia inferior a 15 meses. Aunque la cirugía, la radioterapia y la quimioterapia son los tratamientos estándar, sólo ofrecen beneficios modestos y la recurrencia es frecuente. Dado el mal pronóstico del GBM, existe una necesidad urgente de nuevas terapias. La inmunoterapia con células dendríticas (CD) se ha revelado como un método prometedor para potenciar la respuesta inmunitaria antitumoral del organismo. Como células presentadoras de antígenos «profesionales», las CD desempeñan un papel crucial en la iniciación de respuestas inmunitarias contra los tumores. Los estudios preclínicos han demostrado la prolongación de la supervivencia y la memoria inmunitaria en modelos murinos de GBM con la estimulación de la actividad de los DC mediante diversos antígenos y moléculas coestimuladoras.
De Vleesvchouwer et al. y Wheeler et al. realizaron grandes ensayos de fase II con 56 y 23 pacientes con GBM, respectivamente. En el estudio de De Vleesvchouwer, los pacientes >3 años de edad se inscribieron en un ensayo prospectivo de comparación de cohortes (HGG-IMMUNO) en el que pacientes con GBM recurrente fueron tratados con DCVs pulsadas con células tumorales autólogas en tres cohortes, donde cada cohorte sirvió como control histórico para las cohortes siguientes. En la cohorte A, la DCV se administró en la semana 1 y 3 y después cada 4 semanas. En la cohorte B, se administraron cinco vacunas de CC a intervalos de 2 semanas y después cada 4 semanas. En la cohorte C, se administraron 4 vacunaciones semanales de DC con refuerzos de inyecciones intradérmicas de lisado tumoral. Los autores hallaron una tendencia a la mejora de la SLP y la SG en los pacientes menores de 35 años. Un análisis de subgrupos de pacientes mayores de 21 años mostró una mejora de la SLP y la SG en la cohorte C, pacientes tratados con administraciones semanales de vacunas y refuerzos. Wheeler et al. estudiaron la eficacia de la DCV en pulsos de lisado tumoral administrada por vía subcutánea en 33 pacientes con GBM, 23 recurrentes y 11 recién diagnosticados, a intervalos de 2 semanas durante tres dosis y una cuarta vacunación 6 semanas después de la tercera. Un paciente desarrolló un GBM metastásico alrededor del lugar de la inyección de la vacuna y se pensó que se debía al crecimiento de células tumorales raras resistentes a la radiación presentes en este paciente en particular y no a una metástasis del tumor primario original. La SLP y la SG en los individuos vacunados se compararon favorablemente con los pacientes que no se sometieron a tratamiento con DCV en la institución del ensayo durante el tiempo del ensayo. Diecisiete de los 34 pacientes con GBM mostraron una respuesta positiva a la vacuna y siete de ellos presentaron >Aumento de 1,5 veces en la producción de IFN-γ antes de la vacunación, lo que sugiere una respuesta antitumoral endógena. Descubrieron que la mediana de supervivencia en los pacientes que respondieron a la vacuna fue de 642 días, frente a 430 días en los que no respondieron. La SLP fue de 308 días en los pacientes que respondieron a la vacuna, frente a 167 días en los que no respondieron.
Los estudios preclínicos y clínicos han demostrado una respuesta inmunológica mensurable y tasas de supervivencia más o menos prolongadas. Varias combinaciones de adyuvantes sinérgicos destinadas a superar la inmunosupresión inducida por el glioma han resultado prometedoras. El informe provisional del primer ensayo de fase III de la DCV en el GBM recién diagnosticado confirma la seguridad y la viabilidad y sugiere una supervivencia mayor de la esperada con la DCV. Mientras esperamos con impaciencia los resultados finales del estudio y los resultados de otros estudios de fase III, es necesario seguir explorando la combinación óptima de terapias inmunológicas, la integración ideal de estas terapias en el tratamiento estándar actual y los fenotipos respondedores para identificar a los pacientes con más probabilidades de beneficiarse de la terapia.
REGISTERED ADDRESS:
Immunyo Ltd
Kincora Ave 35
Clontarf
Dublin 3
Ireland